- 医療情報
- 眼内悪性リンパ腫治験について
治験タイトル
眼内悪性リンパ腫に対する副作用を軽減させたBruton型チロシンキナーゼ阻害剤を用いた医師主導多施設共同治験
本研究は、2019年度革新的がん医療実用化研究事業一次公募(領域 3 – 2)日本発の革新的がん治療薬(再生医療等製品を含む)の開発・薬事承認を目指した医師主導治験です。
概要
眼内悪性リンパ腫患者の方を対象に、ブルトンキナーゼ阻害剤(ONO-4059)という再発抑制効果が期待される治療薬の効果と安全性を検討します。
| 課題名 | 原発性眼内悪性リンパ腫に対するONO 4059 (ブルトンキナーゼ阻害剤)の医師主導による第 相二重盲検比較試験 |
| 治験調整医師 | 東京大学医学部附属病院 田岡 和城 |
| 実施診療科 | 血液・腫瘍内科 |
| 責任医師名 | 田岡 和城 |
| 治験薬名 | チラブルチニブ塩酸塩(ONO-4059) |
| 予定される効能・効果 (期待される効果) |
原発性眼内悪性リンパ腫寛解後の再発抑制 |
治験薬について
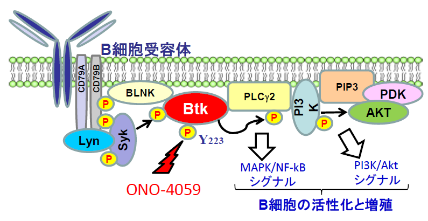
ブルトンキナーゼはB細胞の活性化と増殖に関与しています。ONO-4059を経口投与することによってブルトンキナーゼの活性化を抑制し、再発を抑制することができ、生命予後の改善が見込まれます。また、脳への放射線照射を回避できるので、白質脳症による機能障害などを免れます。この薬剤は外来で処方される飲み薬のため、身体的・精神的負担が小さいことに加え、他の抗腫瘍薬に比べて副作用が少ないので、高齢者でも使用できます。
| 名称 | チラブルチニブ塩酸塩(ONO-4059) 販売名:ベレキシブル |
| 開発会社 | 小野薬品工業株式会社 提携先 Gilead 社(US) |
| 剤型 | 錠剤 |
| 投与経路 | 経口 |
| 作用機序 | BTK阻害剤
|
参加いただける方
・性別:不問
・年齢(同意取得時):20 歳以上
・初発原発性眼内悪性リンパ腫と診断され、眼への局所治療後に眼病変及び脳・全身の中央画像判定により完全
寛解と診断された患者
・本登録から21日以内に治験薬の投与開始ができる患者(早期開始を推奨)
・Performance Status(PS) が0または1の患者
・スクリーニング期に実施した最新の臨床検査値が下記の基準を満たす患者
・好中球数が1000/㎜3以上
・血小板数が50000/m㎥以上
・ヘモグロビンが8.0g/dL以上
・AST(GOT)及びALT(GPT)が施設基準値上限の2.5倍未満
・総ビリルビンが施設基値上限の1.5倍未満
・クレアチニンクリアランスが 30 mL/min(Cockcroft-Gault formula)以上
治験を検討される方は現在担当されている医師へご相談ください。
参加いただけない方
・脳病変が認められる眼内悪性リンパ腫の患者
・全身性のリンパ腫病変を有する患者
・続発性の眼内悪性リンパ腫の患者
・T細胞性リンパ腫の患者
・眼病変の評価が不可能な患者
・眼内悪性リンパ腫の診断日以降に全身化学療法又は全脳照射療法を受けた患者
・本登録前14日以内に放射線療法又は眼局所療法を受けた患者
・本登録前28日以内に手術を受けた患者
・本登録前28日以内に眼への局所治療(又は、眼局所療法))を除くすべての未承認薬(臨床研究による投与)
未承認の配合薬、新剤形薬も含む)の投与を受けた患者
・本登録前14日以内に全身性副腎皮質ホルモン(プレドニン換算で10㎎/日以上)を継続して使用している患者
・本登録前14日以内にCYP3A4誘導剤,P-gp誘導剤又は強力なCYP3A4阻害剤の投与を受けた患者
本試験のデザイン
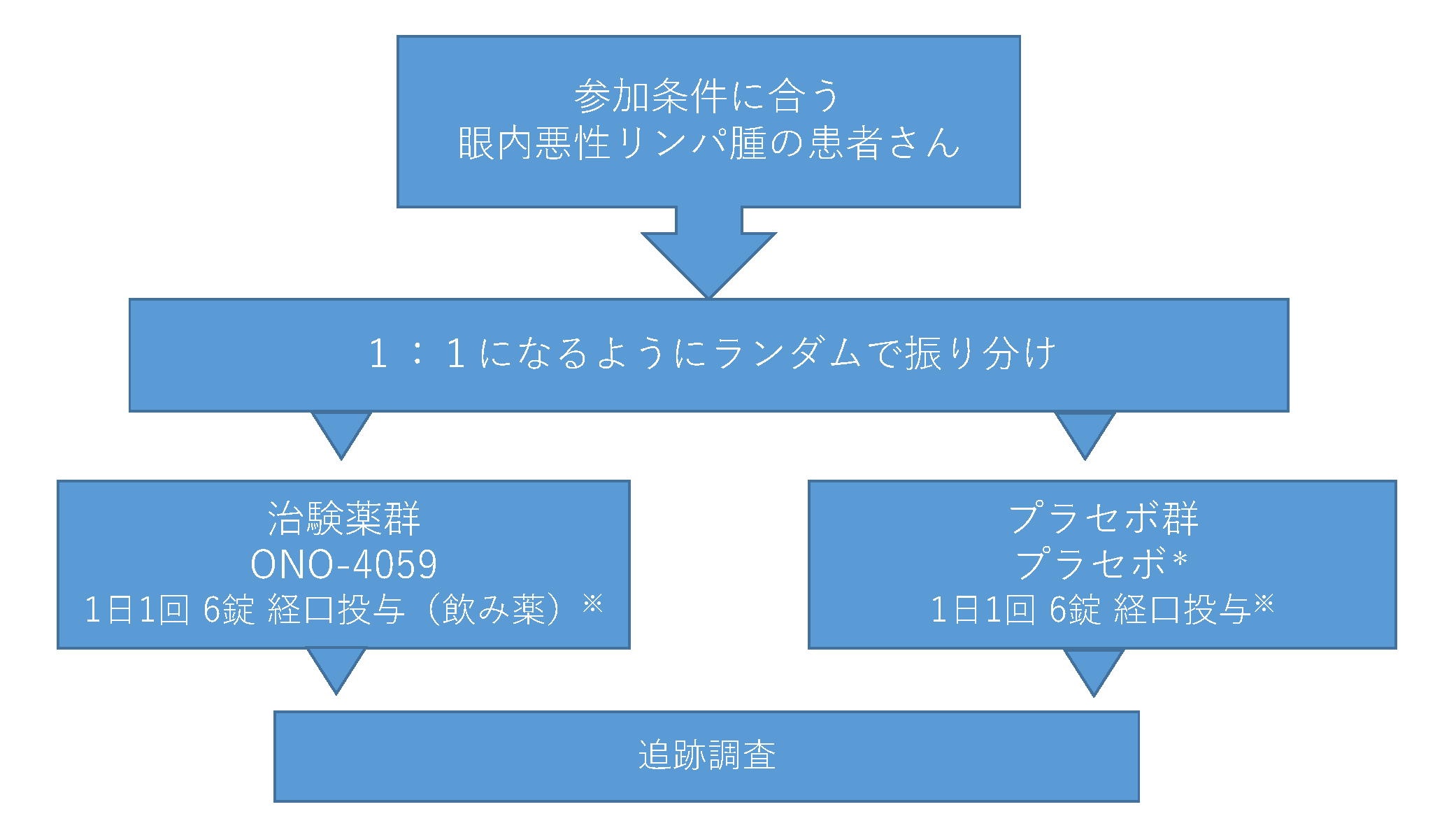
*:プラセボとは見た目は治験薬を同じですが、薬としての効く目のある成分を全く含んでいないものです。
※:減量する場合もあります。
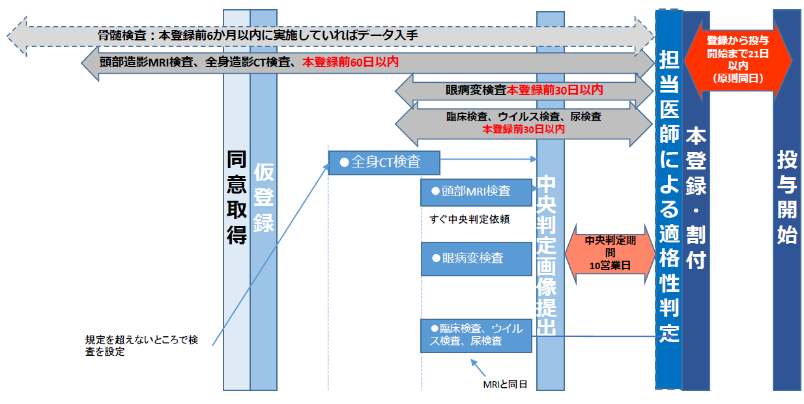
スケジュール
投与開始までのスケジュール
投与・検査スケジュール
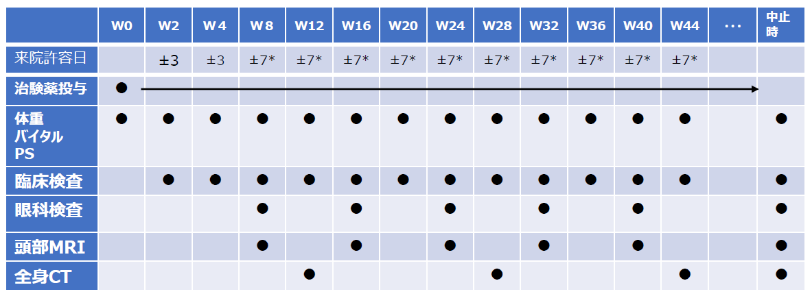
・治験薬は、再発判定または所定の有害事象等が発生するまで投与。投与中止後も原則8週ごとの診察でフォ
ローを行う
・頭部MRI は 8 週ごと、全身 CT は 16 週ごとに撮影
・眼科検査時の画像及びMRI 、 CT 画像はそれぞれ中央判定委員に判定を依頼(約10 営業日で判定結果をフィー
ドバック予定)
*来院許容日は8週目以降は原則 7 日だが、長期休業時、検査日程の都合などで難しい場合は、14 日まで許容する。その場合は
治験薬の払い出しに留意する
主要・副次評価項目
主要評価項目
・無再発生存期間(RFS)
無作為化日から中央判定で再発判定されるまでの期間
副次評価項目
・全生存期間(OS)
・脳・中枢神経系への再発
・眼内への再発
・その他の部位への再発
注意事項
併用禁止薬(療法)
・プレドニゾロンなど全身性副腎皮質ホルモン
(ただし、皮膚障害などの有害事象が認められた患者への投与は許容される)。
・悪性腫瘍に対する治療(化学療法、免疫療法、造血幹細胞移植など)
・他の未承認薬(臨床研究による投与、未承認の配合薬、新剤形薬も含む)
・強力な CYP3A4 阻害剤
・CYP3A4誘導剤、P-gp誘導剤
併用注意薬(療法)
・CYP 3 A 4 5 、 OAT 3 、 OATP 1 B 1 、 MATE 1 、 OCT 1 、 OCT 2 若しくは P gpで代謝又は輸送される薬剤
治験実施予定期間
2021年2月~2025年1月
治験を検討される方は現在担当されている医師へご相談ください。